Механизмы низкочастотной лазерной терапии и светотерапии

Введение
Возможность использования низкоинтенсивного света видимого или ближнего инфракрасного диапазона в целях уменьшения боли, воспалительных процессов и отека, заживления ран и предотвращения повреждения тканей известно уже почти сорок лет с момента изобретения лазеров. К первоначальным свойствам лазерного излучения (холодный лазер) на сегодняшний день добавились и новые, включая фотобиомодуляцию и фотобиостимуляцию с использованием некогерентного света. Несмотря на многочисленные сообщения о положительных результатах экспериментов, проведенных in vitro, в моделях на животных и в рандомизированных контролируемых клинических испытаниях, вопрос о НИЛТ остается нерешенным, что, вероятно, связано с двумя основными причинами.
Во-первых, не полностью понятны биохимические механизмы, лежащие в основе положительных эффектов от лазерной терапии.
Во-вторых, сложность рационального выбора среди большого количества параметров излучения, таких как длина волны, плотность, интенсивность, структура импульса и продолжительность терапии, привела к публикации ряда как негативных, так и положительных отзывов. В частности, наблюдалась реакция применения двухфазной дозы облучения, когда низкоинтенсивный свет имел гораздо лучший эффект относительно высокоинтенсивного излучения.
Настоящий вводный обзор будет посвящен некоторым из предложенных клеточных хромофоров, ответственных за влияние видимого света на клетки млекопитающих, включая цитохром с-оксидазу (с пиками поглощения в ближней инфракрасной спектральной области) и фотоактивные порфирины. Предполагается, что митохондрии являются вероятным сайтом начальной реакции организма на свет, приводя к увеличению синтеза АТФ, модуляции активных форм кислорода и индукции транскрипционных факторов. Эти эффекты, в свою очередь, приводят к увеличению пролиферации и миграции клеток (в частности, фибробластов), модуляции цитокинов, факторов роста и медиаторов воспаления и повышенной оксигенации тканей.
Результаты этих биохимических и клеточных изменений у животных и пациентов включают такие преимущества, как ускорение заживления ран, улучшение прогнозов при спортивных травмах, уменьшение боли при артрите и невропатии, а также быструю реабилитацию после сердечных приступов, инсульта, повреждения нервной ткани.
История
В 1967 году, спустя несколько лет после того, как был изобретен первый рабочий лазер, Эндре Местер из Университета Семмельвейса в Будапеште, Венгрия, захотел проверить, может ли лазерное излучение провоцировать рост раковых клеток у мышей [1]. Сбрив волосы на спине, Местер разделил мышей на две группы и подверг низкоинтенсивным излучением рубиновым лазером (694 нм) одну группу. К его удивлению волосы на обработанной лазерной терапией группе выросли быстрее. Это была первая демонстрация «лазерной биостимуляции».
С тех пор медицинское лечение источниками когерентного света (лазерами) или некогерентным светом (светоизлучающие диоды, светодиоды) начало интенсивно развиваться в медицине. В настоящее время в области физической терапии во многих частях мира практикуется низкоинтенсивная лазерная терапия (НИЛТ), также известная как «холодный лазер», «мягкий лазер», «биостимуляция» или «фотобиомодуляция». Фактически, светотерапия является одним из самых старых терапевтических методов, используемых людьми (исторически как светотерапия у египтян, а позже как УФ-терапия, благодаря которой Нильс Финсен стал обладателем Нобелевской премии в 1904 году [2]). Использование лазеров и светодиодов в качестве источников света стало следующим шагом в технологическом развитии светотерапии. В НИЛТ вопрос уже не в том, имеет ли свет биологические эффекты, а в том, как энергия от терапевтических лазеров и светодиодов работает на клеточном и органном уровнях и каковы оптимальные параметры света для различных источников света.
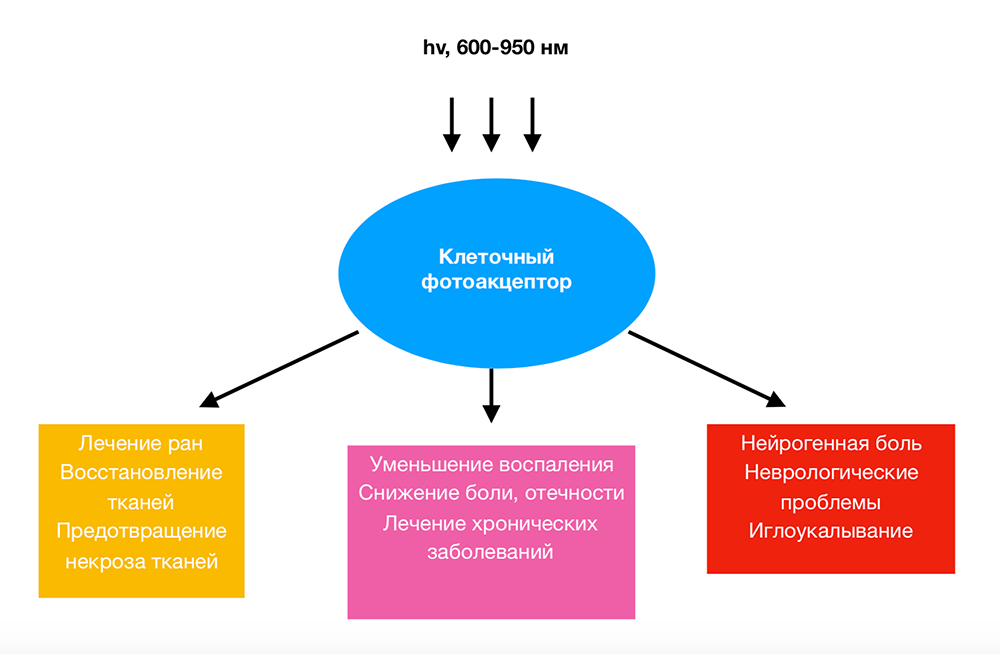
Одним из важных моментов, которые были продемонстрированы в многочисленных исследованиях в клеточных культурах [3], моделях животных [4] и в клинических исследованиях, является концепция двухфазного дозозависимого эффекта, когда результат сравнивается с общей суммарной плотностью энергии света (флюенсом). Причина, по которой метод называется низкоинтенсивным, заключается в том, что существует оптимальная доза света для любого конкретного применения, а дозы ниже этого оптимального значения или, что более важно, больше оптимального значения, будут иметь уменьшенный терапевтический результат, а зачастую высокие дозы света могут привести к отрицательному результату. Возможно, существуют три основные области медицины и ветеринарной практики, в которых НИЛТ играет важную роль (рисунок 1).
Это: (i) заживление ран, восстановление тканей и предотвращение клеточной смерти; (ii) облегчение воспаления при хронических заболеваниях и травмах с его ассоциированной болью и отеком; (iii) облегчение нейрогенной боли. Предлагаемые пути объяснения механизмов НИЛТ должны в идеале быть применимы ко всем этим условиям.
Биохимические механизмы
Фотобиология тканей
В первом законе фотобиологии говорится, что для видимого света малой мощности, имеющего какое-либо влияние на живую биологическую систему, фотоны должны поглощаться электронными полосами поглощения, принадлежащими некоторому молекулярному хромофору или фотоацептору [5]. Один из подходов к нахождению идентичности этого хромофора – осуществление спектрального воздействия. Графическое изображение, представляющее биологический ответ в зависимости от длины волны, частоты или энергии фотонов должно совпадать со спектром поглощения молекулы фотоацептора. Тот факт, что структурированный спектр действия может быть построен графически поддерживает гипотезу о существовании клеточных фотоацепторов и сигнальных путей, стимулируемых светом.
Второе важное соображение касается оптических свойств ткани. Как поглощение, так и рассеяние света в ткани зависят от длины волны выше в синей области спектра, чем в красной, так и основной хромофор ткани (гемоглобин) имеет высокую поглощающую способность волн короче 600 нм. По этим причинам существует так называемое «оптическое окно». Вода начинает значительно поглощать свет при длинах волн больше 1150 нм. По этим причинам в тканях, подвергнутых воздействием красного и инфракрасного спектров, имеется так называемое «оптическое окно», где максимальное проникновение света в ткань максимизируется (рис. 2). Поэтому, хотя синий, зеленый и желтый свет может оказывать значительное влияние на клетки, растущие в оптически прозрачной культуральной среде, использование НИЛТ у животных и пациентов почти исключительно связано с красным и ближним инфракрасным светом (600-950 нм).
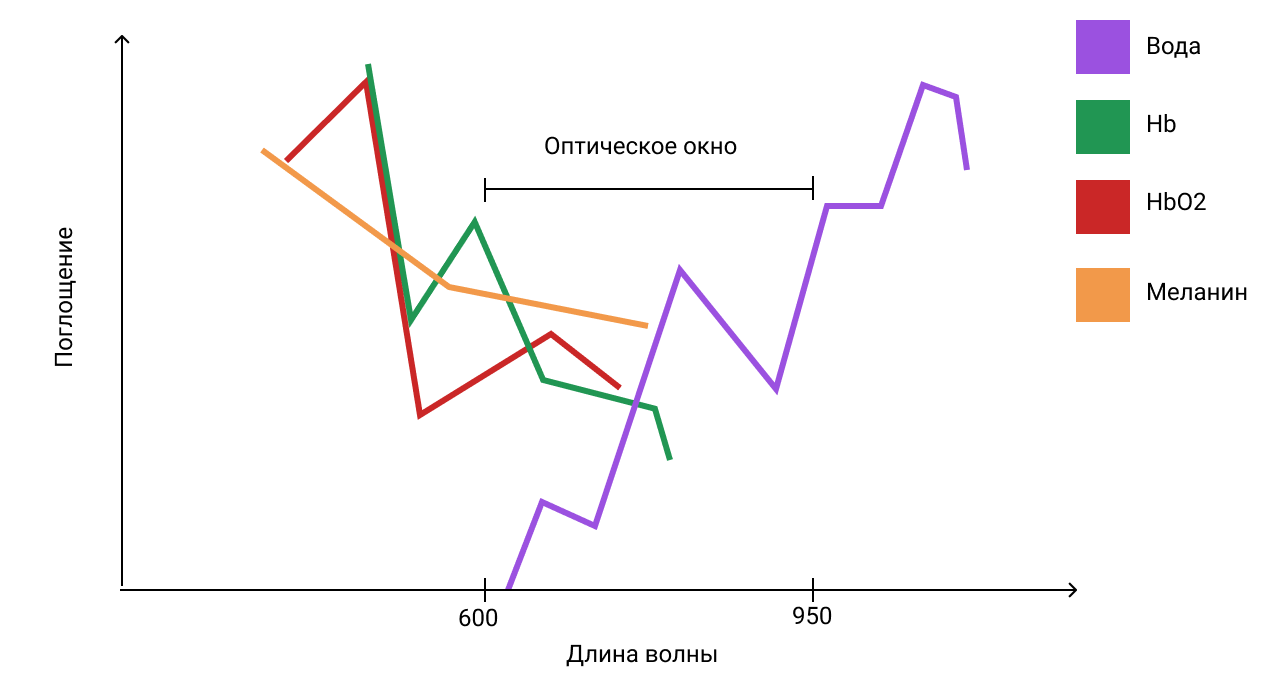
Рисунок 2. Оптическое окно ткани вследствие уменьшения поглощения красной и ближней инфракрасной длин волн (600-1200 нм) тканевыми хромофорами.
Спектры действия
В 1989 году было высказано предположение о том, что механизм действия НИЛТ на клеточном уровне основан на поглощении монохроматического видимого и NIR-излучения компонентами цепи переноса электронов клеток [6]. Внутренняя митохондриальная мембрана содержит 5 комплексов интегральных мембранных белков: NADH-дегидрогеназу (комплекс I), сукцинатдегидрогеназу (комплекс II), цитохром-редуктазу (комплекс III), цитохромоксидазу (комплекс IV), АТФ-синтазу (комплекс V) и двух свободно диффундирующих молекул убихинона и цитохрома с, которые перемещают электроны от одного комплекса к другому (рис. 3). Дыхательная цепь совершает ступенчатый перенос электронов от NADH и FADH2 (образующихся в цикле лимонной кислоты) к молекулам кислорода с образованием (с помощью протонов) молекул воды, используя энергию, выделяемую этим протонным переносом, на перекачку протонов (H+) от матрицы к межмембранному пространству. Протонный градиент, образованный мембранным процессом активного транспорта, образует миниатюрный аккумулятор. Протон может проходить обратно вниз по этому градиенту, возвращаясь к матрице, только через другой комплекс интегральных белков во внутренней мембране, комплекс АТФ-синтазы.
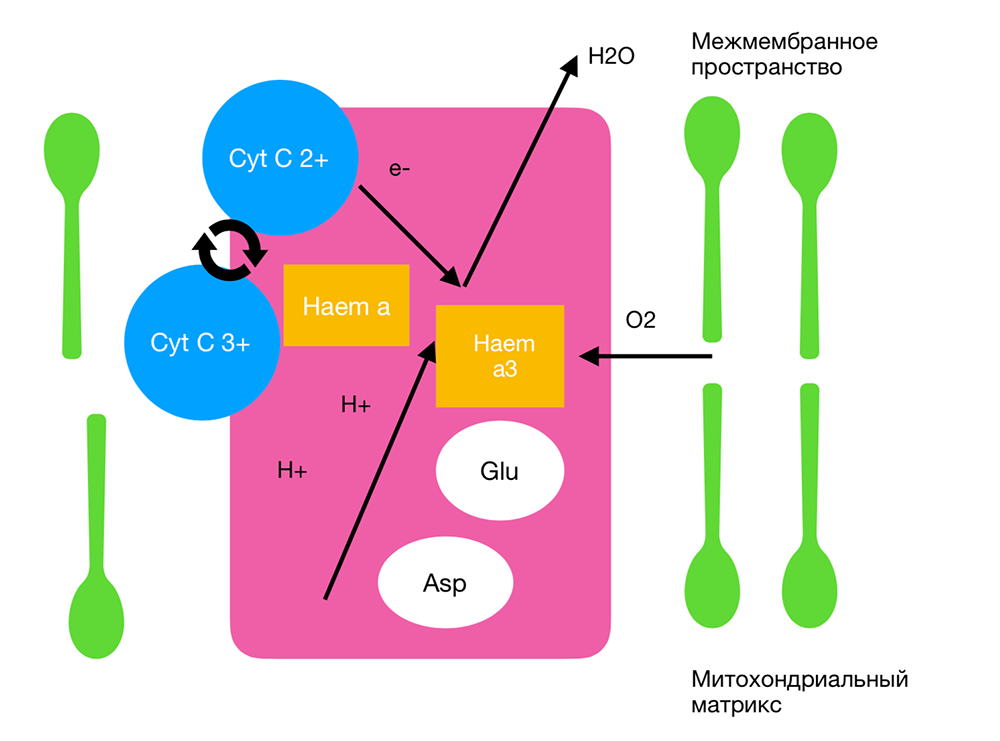
Рис 1. Структура и принцип работы цитохром с-оксидазы.
Спектры поглощения цитохром с-оксидазы, полученные в разных состояниях окисления, были зарегистрированы и оказались очень похожими на спектры действия для биологических реакций на свет. Поэтому было предложено, чтобы цитохром с-оксидаза являлась основным фотоакцептором для красного и NIR-диапазона в клетках млекопитающих [7] (рисунок 4). Цитохром с-оксидаза содержит два центра железа, haem a и haem a3 (также называемые цитохромами a и a3) и два медных центра CuA и CuB [8]. Полностью окисленная цитохромоксидаза имеет как атомы железа в степени окисления Fe(III), так и атомы меди в степени окисления Cu(II), в то время как полностью восстановленная цитохрома c-оксидаза имеет железо в степени окисления Fe(II) и меди Cu(I). Существует много промежуточных смешанно-валентных форм фермента и других координатных лигандов, таких как CO, CN и формиат. Все эти отдельные окислительно-восстановительные состояния фермента имеют разные спектры поглощения [9], что, вероятно, объясняет незначительные различия в спектрах действия НИЛТ, о которых сообщалось. В недавней работе группы Karu [10] приведены следующие диапазоны длин волн для четырех пиков в спектре действия НИЛТ: 1) 613,5 - 623,5 нм, 2) 667,5 - 683,7 нм, 3) 750,7 - 772,3 нм, 4) 812,5 - 846,0 нм.
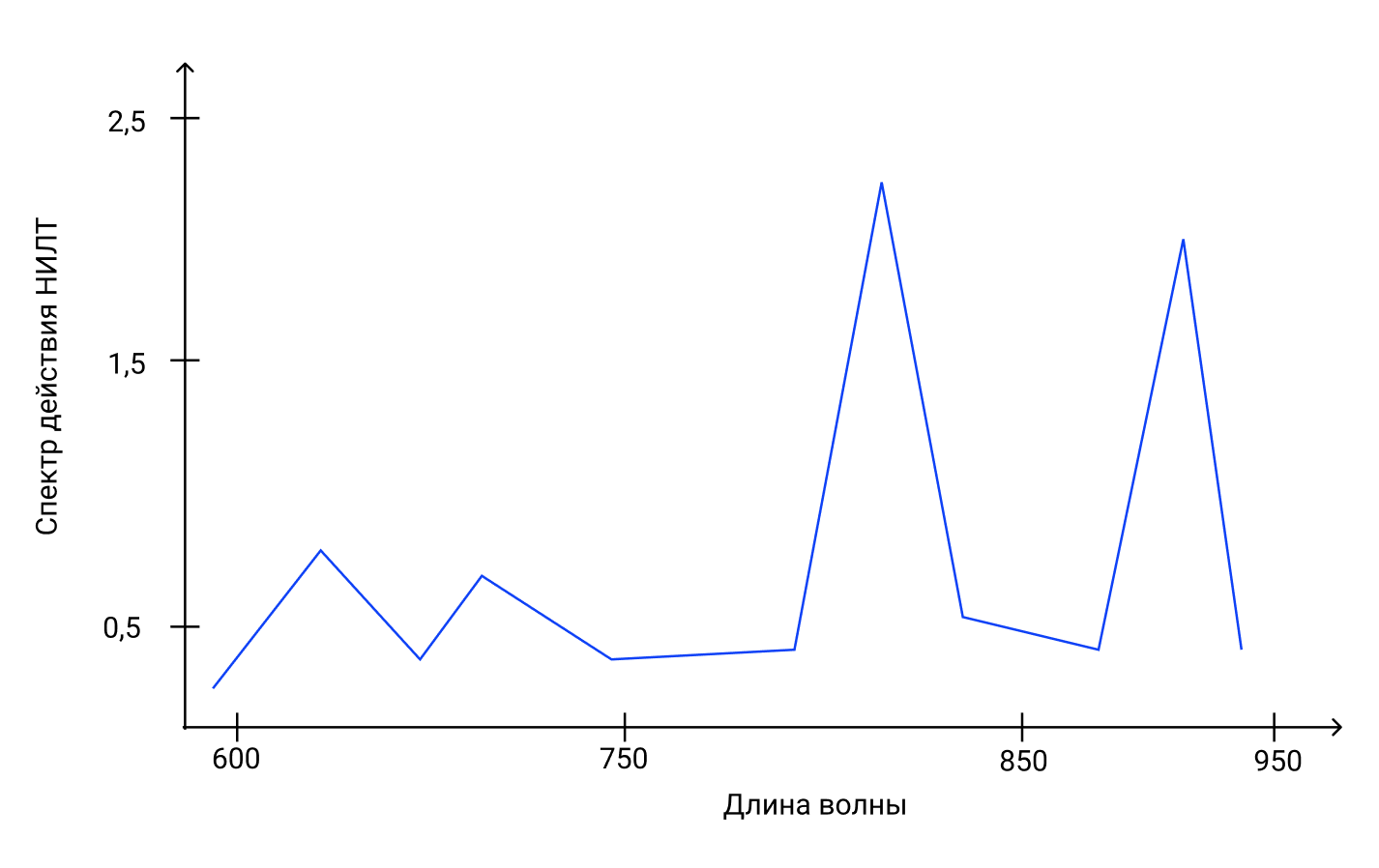
Рисунок 5. Спектр действия НИЛТ в культуральных клетках, у животных и пациентов. Представленные данные являются объединением многих отчетов из нескольких лабораторий.
В исследовании, проведенном Pastore et al [11], изучалось влияние излучения He-Ne лазера на цитохром c-оксидазу. Было обнаружено повышенное окисление цитохрома c и увеличение скорости переноса электронов. Артюхов и его коллеги обнаружили [12] повышенную ферментативную активность каталазы после воздействия He-Ne.
Поглощение фотонов молекулами приводит к электронно-возбужденным состояниям последних и, следовательно, может привести к ускорению реакций в дыхательной цепи [13]. Ускорение электронного транспорта обязательно приводит к увеличению производства АТФ [14]. Увеличение синтеза АТФ и увеличение градиента протонов приводит к увеличению активности антипортеров Na+/H+ и Ca2+/Na+ и всех АТФ-зависимых ионных транспортеров, таких как Na+/K+ АТФаза и Са2+. АТФ является субстратом для аденилатциклазы, поэтому уровень АТФ контролирует уровень цАМФ. Оба Ca2+ и cAMP очень важны для вторичных мессенджеров. Особенно это касается ионов кальция, которые регулируют почти каждый процесс в организме человека.
В дополнение к опосредованному цитохром с-оксидазой увеличению производства АТФ НИЛТ может ускорять и другие механизмы. Первым из них мы рассмотрим «гипотезу синглетного кислорода». Некоторые молекулы, поглощающие видимый спектр, такие как порфирины, и не имеющие в активных центрах металлов с переходной валентностью [15], а также некоторые флавопротеины [16], после поглощения фотона могут на продолжительное время переходить возбужденное состояние, впоследствии имея возможность взаимодействовать с кислородом, что будет приводить к образованию реакционноспособного синглетного кислорода. Это та самая молекула, которая используется в фотодинамической терапии (PDT) для уничтожения раковых клеток, разрушения кровеносных сосудов и уничтожения микробов. Исследователи PDT давно знают, что очень низкие дозы PDT могут вызвать пролиферацию клеток и стимуляцию тканей вместо убийства, наблюдаемого при высоких дозах [17].
Следующим предложенным механизмом была «гипотеза изменения редокс-свойств» [18]. Изменение метаболизма митохондрий и активация дыхательной цепи путем светового воздействия также увеличило бы производство супероксидных анионов O2•-. Было показано, что клеточное образование O2- зависит в основном от метаболического состояния митохондрий. Другие окислительно-восстановительные цепи в клетках также могут быть активированы НИЛТ. NADPH-оксидаза представляет собой фермент, обнаруженный на активированных нейтрофилах и способный к немитохондриальной окислительной вспышке, индуцируя образование больших количеств ROS [19]. Эти эффекты зависят от физиологических параметров организма, а также от параметров излучения.
Активность цитохром c-оксидазы подавляется оксидом азота (NO). Это ингибирование митохондриального дыхания NO, являясь обратимым процессом, может быть объяснено прямой конкуренцией между NO и O2 на восстановленном двухъядерном центре CuB/a3 цитохром c-оксидазы [20]. Было предложено, что лазерное излучение способно нивелировать подобный процесс и, таким образом, повышая скорость дыхания (NO гипотеза) [21]. Недавно опубликованные данные Karu et al. [21], косвенно подтверждают эту гипотезу. Другим доказательством участия NO в ответах на НИЛТ является увеличение продукции NO-синтазы при воздействии светом (635 нм) [22]. Хотя оба наблюдения подтверждают гипотезу зависимости уровня NO в ответ на НИЛТ, отклик на разные длины волн в различных исследовательских моделях могут регулироваться различными механизмами.
Клеточный сигналинг
Комбинация продуктов окислительного потенциала и восстановительной способности связанных редокс-пар, присутствующих в клетках и тканях, представляет собой окислительно-восстановительную среду (редокс-состояние) клетки. К окислительно-восстановительным парам, присутствующим в клетке, относятся: никотинамидадениндинуклеотид (окисленные/восстановленные формы) NAD / NADH, никотинамидадениндинуклеотидфосфат NADP/NADPH, пара глутатиона/восстановленного глутатиона GSH/GSSG и пара тиоредоксина/дисульфида тиоредоксина Trx(SH)2/TrxSS [23]. Несколько важных путей регуляции опосредуются через клеточное редокс-состояние. Изменения в окислительно-восстановительном состоянии индуцируют активацию многочисленных внутриклеточных сигнальных путей, регулируя синтез нуклеиновых кислот и белка, ферментативную активность и прогрессию клеточного цикла [24]. Эти клеточные реакции, в свою очередь, индуцируют транскрипционные изменения. Некоторые факторы транскрипции регулируются изменениями редокс-состояния клетки. Среди них редокс фактор-1 (Ref-1)-зависимый активирующий белок-1 (AP-1) (Fos и Jun), ядерный фактор B (NF-B), p53, транскрипционный фактор/цАМФ-связывающего белка (ATF/CREB), фактор, индуцируемый гипоксией (HIF)-1 и HIF-подобный фактор. Как правило, окисленная форма редокс-зависимых транскрипционных факторов обладает низкой ДНК-связывающей активностью. Ref-1 является важным фактором для специфического сокращения факторов транскрипции. Однако, было также показано, что низкие уровни оксидантов, по-видимому, стимулируют пролиферацию и дифференцировку некоторых типов клеток [25-27].
Предполагается, что НИЛТ производит сдвиг общего окислительно-восстановительного потенциала клетки в сторону большего окисления [28]. Различные клетки в диапазоне условий роста имеют отчетливые редокс-состояния. Поэтому эффекты НИЛТ могут значительно различаться. Клетки, первоначально имеющие более низкий редокс-статус (низкий уровень внутриклеточного рН), обладают высоким потенциалом биологического ответа при воздействии НИЛТ, тогда как клетки в оптимальном редокс-состоянии реагируют слабо или не реагируют на лечение светом вообще.
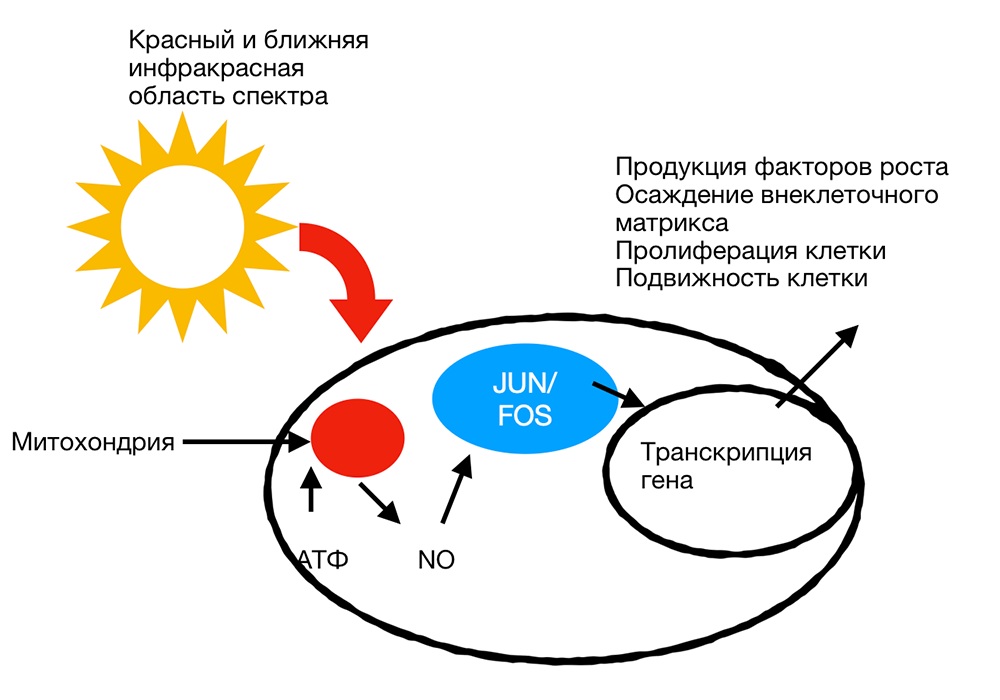
Рисунок 6. Клеточный сигналинг, индуцированный НИЛТ.
Результаты IN VITRO
Типы клеток
Существуют данные о том, что несколько типов млекопитающих и микробных клеток могут реагировать на НИЛТ. Большую часть работы Karu использовала Escherichia coli [29] и клетки HeLa [30], клеточную линию карциномы шейки матки человека. Однако для клинических применений НИЛТ, подлежащих валидации, гораздо важнее изучить влияние НИЛТ на не-злокачественные типы клеток, которые могут быть эффективно стимулированы в целях устранения некоторых заболеваний или травм. Для исследований заживления ран вариация клеток, вероятно, ограничивается эндотелиальными клетками [31], фибробластами [32], кератиноцитами [33] и, возможно, некоторыми классами лейкоцитов, например, макрофаги [34] и нейтрофилы [35]. Для исследований по облегчению боли и восстановлению нервной ткани изучать следует нейроны [36-38] и глиальные клетки [39]. Для противовоспалительных и противоотечных эффектов лазерного излучения – макрофаги [34], тучные клетки [40], нейтрофилы [41], лимфоциты [42] и т.д. Существует литературные данные об эффектах НИЛТ in vitro для большинства из этих типов клеток.
Изолированные митохондрии
Поскольку дыхательная цепь и цитохромоксидазы расположены в митохондриях, несколько групп ученых испытали влияние НИЛТ на изолированных митохондриях. Наиболее популярной системой для изучения является влияние He-Ne лазерного облучения митохондрий, выделенных из печени крыс, в которых наблюдался повышенный электрохимический протонный потенциал и ускоренный синтез АТФ [43]. Индуцированный синтез РНК и белка был продемонстрирован при 5 Дж/см2 [44]. Pastore et al. [45] обнаружили повышенную активность цитохром с-оксидазы и полярографически измеренного увеличения утилизации кислорода при 2 Дж/см2 при применении He-Ne лазера. В облучаемых светом митохондриях обнаружена значительное повышение активности протонного насоса, около 55%-ное увеличение отношения <--H+/e-. Yu et al. [13] использовали лазер 660 нм при удельной плотности 10 мВт/см2, демонстрируя в своей работе повышенное потребление кислорода (0,6 Дж/см2 и 1,2 Дж/см2), увеличенный фосфатный потенциал и энергию пучка (1,8 Дж/см2 и 2,4 Дж/см2), а также повышенную активность НАДН: убихинон-оксидоредуктазы, убихинола: ферроцитохрома C-оксидоредуктазы и ферроцитохрома C: кислород оксидоредуктазы (между 0,6 Дж/см2 и 4,8 Дж/см2).
Животные модели
Было использовано большое количество модельных животных, которые использовались для демонстрации эффектов НИЛТ при различных заболеваниях, травмах, хронических и острых состояниях. Поэтому в настоящем обзоре мы обсудим только три конкретных применения, для которых имеются качественные литературные данные относительно эффективности.
Лечение ран
В литературе по НИЛТ, применяемой для стимуляции заживления ран на различных животных моделях, содержатся как положительные, так и отрицательные исследования. Причины противоречивых сообщений иногда в очень похожих моделях ран, по всей видимости, разнообразны. Вероятно, применение НИЛТ на животных моделях будет более эффективным, если будет выполнено на моделях, которые имеют некоторые определенные физиологические характеристики болезни. Хотя было несколько сообщений о том, что процессы, такие как заживление ран, ускоряются при НИЛТ у нормальных грызунов [3, 34], альтернативный подход заключается в том, чтобы ингибировать исцеление путем индуцирования определенного состояния болезни. Так было сделано в случае диабета, болезни, которая, как известно, значительно уменьшает заживление ран у пациентов. НИЛТ значительно улучшает заживление ран у диабетических крыс [35, 36] и диабетических мышей [37, 38]. НИЛТ также эффективен при лечении мелких ран, вызванных радиационным излучением у мышей [39]. В исследовании [47] у бесшерстных мышей, облучаемых He-Ne лазером в течение 1 и 2 недели, было обнаружено улучшение предела прочности ран на разрыв. Кроме того, общее содержание коллагена было значительно увеличено через 2 месяца, по сравнению с ранами контрольной группы мышей. Благотворное влияние НИЛТ на заживление ран можно объяснить, рассмотрев несколько основных биологических механизмов, включая индукцию экспрессии цитокинов и факторов роста, которые, как известно, отвечают за многие фазы заживления ран. Во-первых, есть отчет [48] о том, что He-Ne лазер повышал уровни белка и мРНК IL-1α и IL-8 в кератиноцитах. Данные цитокины ответственны за начальную воспалительную фазу заживления ран. Во-вторых, есть сообщения [49], что НИЛТ может регулировать цитокины, ответственные за пролиферацию и миграцию фибробластов, таких как bFGF, HGF и SCF. В-третьих, сообщалось [50], что НИЛТ может увеличить количество факторов роста, таких как VEGF, отвечающих за неоваскуляризацию, необходимую для заживления ран. В-четвертых, TGF-β является фактором роста, ответственным за индуцирование синтеза коллагена из фибробластов и, как сообщается, был усилен посредством НИЛТ [51]. В-пятых, имеются сообщения [52, 53] о том, что НИЛТ может индуцировать фибробласты для трансформации в миофибробласты, тип клеток, который экспрессирует α-актин гладкой мускулатуры и десмин, имея при этом фенотип сократительных клеток, ускоряющих заживление раны.
Нейротоксичность
Исследования группы Whelan изучали использование 670-нм светодиодов в борьбе с нейрональными повреждениями, вызванными нейротоксинами. Интоксикация метанолом обусловлена биотрансформацией последнего в муравьиную кислоту, которая вызывает повреждение сетчатки и зрительного нерва, приводя к слепоте. Используя модель крысы и электроретинограмму в качестве чувствительного индикатора функции сетчатки, исследователи продемонстрировали, что три коротких 670-нм светодиодных курса лечения (4 Дж/см2) в течение 5, 25 и 50 ч после интоксикации метанолом уменьшают поражение сетчатки токсином. После терапии наблюдалось восстановление функции у обработанных светом крыс, подтвержденных гистопатологически [54]. В последующем исследовании [55] рассматривались эффекты необратимого ингибитора цитохром c-оксидазы, цианида калия, в культивируемых нейронах. НИЛТ частично восстановила активность ферментов, связанных с 10-100 мкМ цианистого калия. Наблюдалось значительное уменьшение гибели нейронов, вызванное 300 мкМ KCN с 83,6 до 43,5%. Светотерапия значительно восстановила содержание АТФ в нейронах только при концентрации 10 мкМ KCN, но не при более высоких концентрациях KCN. Напротив, светодиод смог полностью отменить отрицательное влияние тетродотоксина, который только косвенно понижал уровень фермента. Среди испытуемых длин волн (670, 728, 770, 830 и 880 нм) наиболее эффективные (830 нм, 670 нм) соответствовали спектру поглощения NIR спектра окисленной цитохром с-оксидазой.
Регенерация нервов
Модели животных использовались для изучения эффектов НИЛТ при восстановлении нервов [56, 57]. Byrnes et al. использовали 1600 Дж/см2 810-нм лазера для улучшения заживления и функциональности при дорсальном синдроме поражения спинного мозга у крыс [39]. Anders et al. [58] изучали НИЛТ как способ регенерации пораженного лицевого нерва у крыс; путем сравнения 361, 457, 514, 633, 720 и 1064 нм, определив наиболее эффективным 162,4 Дж/см2 He-Ne лазер 633 нм.
Клинические исследования
Низкоинтенсивная лазерная терапия используется физиотерапевтами для лечения широкого спектра острых и хронических мышечно-скелетных болей, в стоматологии для купирования воспаления тканей полости рта и для лечения разнообразных язв, в дерматологии для лечения отеков, язв, ожогов, и дерматита, в ортопедии для облегчения боли и лечения хронических воспалений и аутоиммунных заболеваний, а также другими специалистами и врачами общей практики. Лазерная терапия также широко используется в ветеринарной медицине и в клиниках спортивной медицины и реабилитации (для уменьшения отечности и гематом, облегчения боли, улучшения подвижности и лечения травм мягких тканей). Лазеры применяются непосредственно в области патологии или в различных точках на теле. Однако, одним из наиболее важных ограничений для внедрения метода в медицинскую практику является отсутствие надлежащим образом плацебо-контролируемых и слепых клинических испытаний. Испытания должны быть проспективными, плацебо-контролируемыми и двойными слепыми, содержать достаточное количество субъектов, чтобы можно было сделать статистически обоснованные выводы.
Клинические применения низкоинтенсивной лазерной терапии разнообразны и зависят от различных методологий и в зависимости от того, какой именно аппарат используется для терапии, какими характеристиками обладает (длина волны, выходная мощность, непрерывные или импульсные режимы работы, параметры импульса). В последние годы более длинные волны (~800-900 нм) и более высокие выходные мощности (до 100 мВт) были предпочтительнее в терапевтических устройствах, особенно в целях более глубокого проникновения ткани.
Список литературы:
- E. Mester, B. Szende and P. Gartner, The effect of laser beams on the growth of hair in mice, Radiobiol Radiother (Berl) 9 (1968) 621-6.
- R. Roelandts, The history of phototherapy: something new under the sun?, J Am Acad Dermatol 46 (2002) 926-30.
- A.N. Pereira, P. Eduardo Cde, E. Matson and M.M. Marques, Effect of low-power laser irradiation on cell growth and procollagen synthesis of cultured fibroblasts, Lasers Surg Med 31 (2002) 263-7.
- J.S. Kana, G. Hutschenreiter, D. Haina and W. Waidelich, Effect of low-power density laser radiation on healing of open skin wounds in rats, Arch Surg 116 (1981) 293-6.
- J.C. Sutherland, Biological effects of polychromatic light, Photochem Photobiol 76 (2002) 164-70.
- T. Karu, Laser biostimulation: a photobiological phenomenon, J Photochem Photobiol B 3 (1989) 638-40.
- T.I. Karu and N.I. Afanas'eva, Cytochrome c oxidase as the primary photoacceptor upon laser exposure of cultured cells to visible and near IR-range light, Dokl Akad Nauk 342 (1995) 693-5.
- R.A. Capaldi, F. Malatesta and V.M. Darley-Usmar, Structure of cytochrome c oxidase, Biochim Biophys Acta 726 (1983) 135-48.
- I. Szundi, G.L. Liao and O. Einarsdottir, Near-infrared time-resolved optical absorption studies of the reaction of fully reduced cytochrome c oxidase with dioxygen, Biochemistry 40 (2001) 2332-9.
- T.I. Karu and S.F. Kolyakov, Exact action spectra for cellular responses relevant to phototherapy, Photomed Laser Surg 23 (2005) 355-61.
- D. Pastore, M. Greco and S. Passarella, Specific helium-neon laser sensitivity of the purified cytochrome c oxidase, Int J Radiat Biol 76 (2000) 863-70.
- V.G. Artyukhov, O.V. Basharina, A.A. Pantak and L.S. Sveklo, Effect of helium-neon laser on activity and optical properties of catalase, Bull Exp Biol Med 129 (2000) 537-40.
- W. Yu, J.O. Naim, M. McGowan, K. Ippolito and R.J. Lanzafame, Photomodulation of oxidative metabolism and electron chain enzymes in rat liver mitochondria, Photochem Photobiol 66 (1997) 866-71.
- S. Passarella, He-Ne laser irradiation of isolated mitochondria, J Photochem Photobiol B 3 (1989) 642-3.
- H. Friedmann, R. Lubart, I. Laulicht and S. Rochkind, A possible explanation of laser-induced stimulation and damage of cell cultures, J Photochem Photobiol B 11 (1991) 87-91.
- M. Eichler, R. Lavi, A. Shainberg and R. Lubart, Flavins are source of visible-light-induced free radical formation in cells, Lasers Surg Med 37 (2005) 314-9.
- K. Plaetzer, T. Kiesslich, B. Krammer and P. Hammerl, Characterization of the cell death modes and the associated changes in cellular energy supply in response to AlPcS4-PDT, Photochem Photobiol Sci 1 (2002) 172-7.
- R. Lubart, M. Eichler, R. Lavi, H. Friedman and A. Shainberg, Low-energy laser irradiation promotes cellular redox activity, Photomed Laser Surg 23 (2005) 3-9.
- R. Duan, T.C. Liu, Y. Li, H. Guo and L.B. Yao, Signal transduction pathways involved in low intensity HeNe laser-induced respiratory burst in bovine neutrophils: a potential mechanism of low intensity laser biostimulation, Lasers Surg Med 29 (2001) 174-8.
- F. Antunes, A. Boveris and E. Cadenas, On the mechanism and biology of cytochrome oxidase inhibition by nitric oxide, Proc Natl Acad Sci U S A 101 (2004) 16774-9.
- T.I. Karu, L.V. Pyatibrat and N.I. Afanasyeva, Cellular effects of low power laser therapy can be mediated by nitric oxide, Lasers Surg Med 36 (2005) 307-14.
- Y. Moriyama, E.H. Moriyama, K. Blackmore, M.K. Akens and L. Lilge, In Vivo Study of the Inflammatory Modulating Effects of Low-level Laser Therapy on iNOS Expression Using Bioluminescence Imaging, Photochem Photobiol 81 (2005) 1351-5.
- F.Q. Schafer and G.R. Buettner, Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple, Free Radic Biol Med 30 (2001) 1191-212.
- H. Liu, R. Colavitti, Rovira, II and T. Finkel, Redox-dependent transcriptional regulation, Circ Res 97 (2005) 967-74.
- M. Yang, N.B. Nazhat, X. Jiang, S.M. Kelsey, D.R. Blake, A.C. Newland and C.J. Morris, Adriamycin stimulates proliferation of human lymphoblastic leukaemic cells via a mechanism of hydrogen peroxide (H2O2) production, Br J Haematol 95 (1996) 339-44.
- W.G. Kirlin, J. Cai, S.A. Thompson, D. Diaz, T.J. Kavanagh and D.P. Jones, Glutathione redox potential in response to differentiation and enzyme inducers, Free Radic Biol Med 27 (1999) 1208-18.
- S. Alaluf, H. Muir-Howie, H.L. Hu, A. Evans and M.R. Green, Atmospheric oxygen accelerates the induction of a post-mitotic phenotype in human dermal fibroblasts: the key protective role of glutathione, Differentiation 66 (2000) 147-55.
- T. Karu, Primary and secondary mechanisms of action of visible to near-IR radiation on cells, J Photochem Photobiol B 49 (1999) 1-17.
- O. Tiphlova and T. Karu, Action of low-intensity laser radiation on Escherichia coli, Crit Rev Biomed Eng 18 (1991) 387-412.
- T.I. Karu, L.V. Pyatibrat, G.S. Kalendo and R.O. Esenaliev, Effects of monochromatic low-intensity light and laser irradiation on adhesion of HeLa cells in vitro, Lasers Surg Med 18 (1996) 171-7.
- P. Moore, T.D. Ridgway, R.G. Higbee, E.W. Howard and M.D. Lucroy, Effect of wavelength on lowintensity laser irradiation-stimulated cell proliferation in vitro, Lasers Surg Med 36 (2005) 8-12.
- D. Hawkins and H. Abrahamse, Biological effects of helium-neon laser irradiation on normal and wounded human skin fibroblasts, Photomed Laser Surg 23 (2005) 251-9.
- H.S. Yu, C.S. Wu, C.L. Yu, Y.H. Kao and M.H. Chiou, Helium-neon laser irradiation stimulates migration and proliferation in melanocytes and induces repigmentation in segmental-type vitiligo, J Invest Dermatol 120 (2003) 56-64.
- S. Young, P. Bolton, M. Dyson, W. Harvey and C. Diamantopoulos, Macrophage responsiveness to light therapy, Lasers Surg Med 9 (1989) 497-505.
- Y. Fujimaki, T. Shimoyama, Q. Liu, T. Umeda, S. Nakaji and K. Sugawara, Low-level laser irradiation attenuates production of reactive oxygen species by human neutrophils, J Clin Laser Med Surg 21 (2003) 165-70.
- Y.S. Chen, S.F. Hsu, C.W. Chiu, J.G. Lin, C.T. Chen and C.H. Yao, Effect of low-power pulsed laser on peripheral nerve regeneration in rats, Microsurgery 25 (2005) 83-9.
- M. Miloro, L.E. Halkias, S. Mallery, S. Travers and R.G. Rashid, Low-level laser effect on neural regeneration in Gore-Tex tubes, Oral Surg Oral Med Oral Pathol Oral Radiol Endod 93 (2002) 27-34.
- P. Balaban, R. Esenaliev, T. Karu, E. Kutomkina, V. Letokhov, A. Oraevsky and N. Ovcharenko, He-Ne laser irradiation of single identified neurons, Lasers Surg Med 12 (1992) 329-37.
- K.R. Byrnes, R.W. Waynant, I.K. Ilev, X. Wu, L. Barna, K. Smith, R. Heckert, H. Gerst and J.J. Anders, Light promotes regeneration and functional recovery and alters the immune response after spinal cord injury, Lasers Surg Med 36 (2005) 171-85.
- S.O. el Sayed and M. Dyson, Effect of laser pulse repetition rate and pulse duration on mast cell number and degranulation, Lasers Surg Med 19 (1996) 433-7.
- R.A. Lopes-Martins, R. Albertini, P.S. Martins, J.M. Bjordal and H.C. Faria Neto, Spontaneous effects of low-level laser therapy (650 nm) in acute inflammatory mouse pleurisy induced by Carrageenan, Photomed Laser Surg 23 (2005) 377-81.
- A.D. Agaiby, L.R. Ghali, R. Wilson and M. Dyson, Laser modulation of angiogenic factor production by T-lymphocytes, Lasers Surg Med 26 (2000) 357-63.
- S. Passarella, E. Casamassima, S. Molinari, D. Pastore, E. Quagliariello, I.M. Catalano and A. Cingolani, Increase of proton electrochemical potential and ATP synthesis in rat liver mitochondria irradiated in vitro by helium-neon laser, FEBS Lett 175 (1984) 95-9.
- M. Greco, G. Guida, E. Perlino, E. Marra and E. Quagliariello, Increase in RNA and protein synthesis by mitochondria irradiated with helium-neon laser, Biochem Biophys Res Commun 163 (1989) 1428-34.
- D. Pastore, M. Greco, V.A. Petragallo and S. Passarella, Increase in <--H+/e- ratio of the cytochrome c oxidase reaction in mitochondria irradiated with helium-neon laser, Biochem Mol Biol Int 34 (1994) 817- 26.
- Y. Zhang, S. Song, C.C. Fong, C.H. Tsang, Z. Yang and M. Yang, cDNA microarray analysis of gene expression profiles in human fibroblast cells irradiated with red light, J Invest Dermatol 120 (2003) 849-57.
- R.F. Lyons, R.P. Abergel, R.A. White, R.M. Dwyer, J.C. Castel and J. Uitto, Biostimulation of wound healing in vivo by a helium-neon laser, Ann Plast Surg 18 (1987) 47-50.
- H.S. Yu, K.L. Chang, C.L. Yu, J.W. Chen and G.S. Chen, Low-energy helium-neon laser irradiation stimulates interleukin-1 alpha and interleukin-8 release from cultured human keratinocytes, J Invest Dermatol 107 (1996) 593-6.
- V.K. Poon, L. Huang and A. Burd, Biostimulation of dermal fibroblast by sublethal Q-switched Nd:YAG 532 nm laser: collagen remodeling and pigmentation, J Photochem Photobiol B 81 (2005) 1-8.
- N. Kipshidze, V. Nikolaychik, M.H. Keelan, L.R. Shankar, A. Khanna, R. Kornowski, M. Leon and J. Moses, Low-power helium: neon laser irradiation enhances production of vascular endothelial growth factor and promotes growth of endothelial cells in vitro, Lasers Surg Med 28 (2001) 355-64.
- A. Khanna, L.R. Shankar, M.H. Keelan, R. Kornowski, M. Leon, J. Moses and N. Kipshidze, Augmentation of the expression of proangiogenic genes in cardiomyocytes with low dose laser irradiation in vitro, Cardiovasc Radiat Med 1 (1999) 265-9.
- A.R. Medrado, L.S. Pugliese, S.R. Reis and Z.A. Andrade, Influence of low level laser therapy on wound healing and its biological action upon myofibroblasts, Lasers Surg Med 32 (2003) 239-44.
- E.J. Neiburger, Rapid healing of gingival incisions by the helium-neon diode laser, J Mass Dent Soc 48 (1999) 8-13, 40.
- J.T. Eells, M.M. Henry, P. Summerfelt, M.T. Wong-Riley, E.V. Buchmann, M. Kane, N.T. Whelan and H.T. Whelan, Therapeutic photobiomodulation for methanol-induced retinal toxicity, Proc Natl Acad Sci U S A 100 (2003) 3439-44. [55] M.T. Wong-Riley, H.L. Liang, J.T. Eells, B. Chance, M.M. Henry, E. Buchmann, M. Kane and H.T. Whelan, Photobiomodulation directly benefits primary neurons functionally inactivated by toxins: role of cytochrome c oxidase, J Biol Chem 280 (2005) 4761-71.
- D. Gigo-Benato, S. Geuna and S. Rochkind, Phototherapy for enhancing peripheral nerve repair: a review of the literature, Muscle Nerve 31 (2005) 694-701.
- J.J. Anders, S. Geuna and S. Rochkind, Phototherapy promotes regeneration and functional recovery of injured peripheral nerve, Neurol Res 26 (2004) 233-9.
- J.J. Anders, R.C. Borke, S.K. Woolery and W.P. Van de Merwe, Low power laser irradiation alters the rate of regeneration of the rat facial nerve, Lasers Surg Med 13 (1993) 72-82.