Диабетическая стопа

Влияние низкоинтенсивной лазерной терапии на процесс восстановления тканей хронических ран у пациентов с диабетической стопой.
Авторы: Joelita de Alencar Fonseca Santos, Mariana Barbosa Dias Campelo, Rauirys Alencar de Oliveira, Renata Amadei Nicolau, Veronica Elis Araujo Rezende, Emilia Angela Loschiavo Arisawa.
Резюме
Цель: Проанализировать эффективность использования низкоинтенсивной лазерной терапии (НИЛТ) в процессе восстановления тканей хронических ран у пациентов с диабетической стопой с помощью анализа шкалы PUSH (Pressure Ulcer Scale for Healing), боли и измерения, выполненного с использованием программного обеспечения ImageJ®.
Методы : В данном клиническом испытании приняли участие 18 пациентов от 30 до 59 лет, с осложнением сахарного диабета в виде диабетической стопы. Пациенты были случайным образом распределены пополам в две разные группы: контрольную и основную (получавшие НИЛТ). Параметры оборудования для проведения НИЛТ в данном исследовании: длина волны 660 нм, мощность 30 мВт, излучение в непрерывном режиме, дозиметрия 6 Дж/см2, 48/48 ч в течение 4-недельного периода. Измерение и оценка состояния ран проводились по шкале PUSH, боль оценивалась еженедельно. Для сравнения групп применялся непараметрический U-критерий Манна — Уитни. Результаты: У основной группы пациентов (группа НИЛТ) выявлено значительное увеличение индекса восстановления тканей по сравнению с контрольной группой со значительным статистическим различием (р <0.013). При использовании шкалы PUSH не было выявлено значительной разницы между группами в течение всех недель. Выводы: Использование НИЛТ при хронических ранах у пациентов с диабетической стопой продемонстрировало эффективность в активации процесса восстановления тканей за короткий период.Ключевые слова: диабетическая стопа, фототерапия, хронические раны, заживление ран.
Введение
Сахарный диабет (СД) стал причиной смерти 4,9 миллиона человек в мире в 2014 году [1]. Заболеваемость СД среди взрослого населения увеличивается с каждым годом [2]. Это хроническое заболевание оказывает существенное влияние на ожидаемую продолжительность жизни и качество жизни людей, а также ограничивает их бытовую активность и деятельность, связанную с работой [3, 4]. Наиболее распространенными хроническими осложнениями СД являются нефропатия, ретинопатия, ишемическая болезнь сердца и цереброваскулярные заболевания [4]. Диабетическая стопа, в свою очередь, это невропатическое или ишемическое осложнение, которое вызывает биомеханические изменения дистальной конечности, часто на пальцах ног, в межпальцевых промежутках и на боковых краях стоп [5, 6]. Для того чтобы предотвратить хроническое изъязвление ран и дальнейшую ампутацию конечности, необходимо разрабатывать новые эффективные методы лечения и включать их в обновленные протоколы ведения пациентов с СД [7, 8]. В данной области медицины особое внимание уделяется исследованиям, направленным на поиск терапевтических методов лечения, стимулирующих процессы восстановления тканей. Такими методами являются низкоинтенсивная лазерная терапия (НИЛТ) и низкоинтенсивная светоизлучающая диодная (СИД) терапия [9]. Использование НИЛТ обеспечивает обезболивающее и биостимулирующее действие, способствуя ускорению восстановления тканей [10]. Исследования подтверждают, что НИЛТ может применяться для лечения ран, так как она оказывает противовоспалительный эффект: под ее влиянием происходит разрешение отеков и уменьшение гиперемии; также НИЛТ стимулирует пролиферацию эпителиальных клеток, остеобластов и фибробластов, способствуя синтезу коллагена [11-13].
Методы
Исследование было проведено с участием 18 пациентов-добровольцев, которые были случайным образом распределены на 2 группы по 9 человек: контрольная группа, в которую входили пациенты, получавшие плацебо, и основная, пациенты которой получали НИЛТ. Согласно стандартному терапевтическому протоколу, повреждения в контрольной группе обрабатывали физиологическим раствором (ФР) 0,9% для очистки ложа раны, применяя 2 мг гидрогеля, используя марлю и повязки в качестве вторичного покрытия, каждые 48 часов. Повреждения пациентов из основной группы также обрабатывали ФР 0,9% для очистки ложа раны, с помощью НИЛТ-облучения и, наконец, применяя 2 мг гидрогеля, используя марлю и повязки в качестве вторичного покрытия, также через каждые 48 часов.
Гидрогель является основным покрытием, используемым общепринятым способом в медицинских учреждениях, где имеются амбулатории для лечения ран, поэтому он использовался на ранах добровольцев в обеих группах. Он поддерживает необходимую влажность в зоне применения и способствует аутолитическому очищению раны [3, 14].
Характеристики оборудования и параметры облучения описаны в таблице 1.
Еженедельно состояние пациентов из обеих групп оценивалось с применением шкалы PUSH (Pressure Ulcer Scale for Healing) и ВАШ (визуально-аналоговая шкала). Шкала PUSH использовалась для мониторинга процесса восстановления ткани с учетом трех параметров для оценки результатов вмешательства: площадь раны, количество экссудата и внешний вид ложа раны. Таким образом, учитывая эти три показателя, благодаря шкале PUSH можно по балльной системе оценить состояние раны на момент осмотра, а также динамику ее заживления [15].
ВАШ состоит из одномерной шкалы для оценки интенсивности боли. Она представляет собой линию длиной 10 см с отметками от 0 до 10, где 0 означает отсутствие боли, а 10, соответственно невыносимую боль [16].
Таблица 1. Параметры устройств, применяемых при фототерапии.
| Параметры | |
|---|---|
| Длина волны (λ, нм) | 600 |
| Устройство | Laserpulse Ibramed® |
| Плотность энергии (Дж/см2) | 6 |
| Мощность (Вт) | 0.03 |
| Диаметр светового пятна | 0.28 |
| Размер светового пятна | 0.06 |
| Режим излучения | непрерывный |
| Плотность мощности (Вт/см2) | 0.49 |
| Экспозиция (сек) | 13 |
Результаты
Восемнадцать пациентов были включены в исследование. В таблице 2 представлены их антропометрические характеристики, включающие возраст, индекс массы тела (ИМТ) и значение гликемии после приема пищи, а также локальный статус: время поражения, начальная и конечная площадь, глубина и индекс заживления раны. Существенные (значимые) различия в возрасте и ИМТ между группами отсутствовали. Все пациенты в исследовании были с уровнями глюкозы в крови после приема пищи> 140 мг/дл через 2 ч после еды (гипергликемия согласно критериям, установленными Всемирной организацией здравоохранения). Статистическая разница гипергликемии пациентов между группами отсутствовала (р> 0.931) (Таблица 2). У пациентов из основной группы отмечалось видимое образование эпителиальной ткани в 55,5% (n = 5) ран в течение 4-недельного периода (рис. 1).
У пациентов из основной группы отмечалось выраженное восстановление тканей, несмотря на то что все у всех была гипергликемия, со значительной разницей (р <0.013) по сравнению с контрольной группой (рис. 2).
В течение нескольких недель наблюдалось увеличение внутригрупповой разницы, и на 4-й неделе эта разница была статистически значимой (p <0.0004) в изменении состояния ран по шкале PUSH (рис. 3).
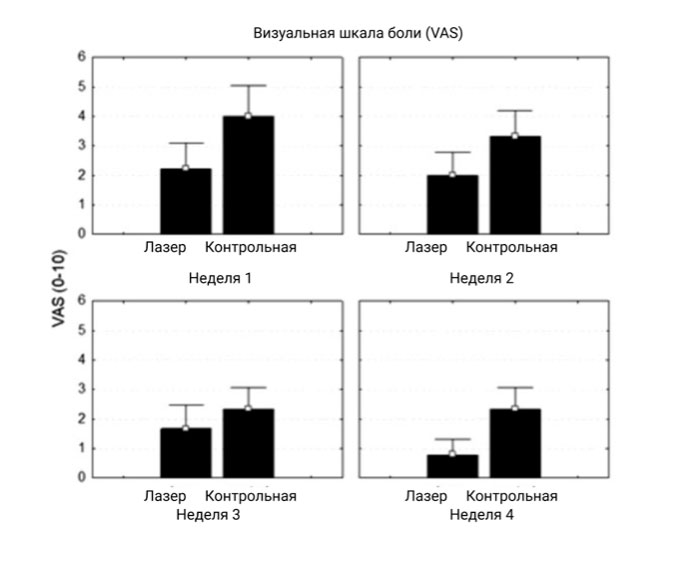
Результаты, полученные при еженедельном мониторинге больных с применением ВАШ у пациентов обеих исследуемых групп, не выявили существенных различий в отношении этого параметра, с учетом того, что значение p не было значимым (p> 0.05) в течение всех недель исследования (рис. 4).
Таблица 2. Антропометрические и клинические характеристики (локальный статус) контрольной и основной групп пациентов (среднее ± стандартное отклонение)
| Контрольная группа (n = 9) | Основная группа (n = 9) | ||
|---|---|---|---|
| Среднее + СО | Среднее + СО | Двусторонний точный pa | |
| Возраст (годы) | 48.33 – 12.09 | 53.11 – 8.85 | 0.863307 |
| ИМТ (кг/м2) | 25.23 – 3.78 | 28.09 – 5.71 | 0.077005 |
| Гликемия (мг/дл) | 191.33 – 67.94 | 201.33 – 90.50 | 0.931427 |
| Время поражения (мес) | 13.00 – 13.58 | 6.00 – 7.23 | 0.314690 |
| Начальная площадь (см2) |
2.97 – 1.66 |
1.83 – 1.08 | 0.135911 |
| Конечная площадь (см2) |
1.63 – 1.57 |
0.32 – 0.26 | 0.031469 |
| Начальная глубина (см) | 0.26 – 0.29 | 0.12 – 0.24 | 0.297326 |
| Индекс заживления ран | 51.29 – 31.61 | 76.45 – 18.30 | 0.013591 |
| Шкала PUSH | |||
| Неделя 1 | 9.33 – 1.50 | 7.33 – 1.32 | 0.014192 |
| Неделя 2 | 8.77 – 1.98 | 6.22 – 1.20 | 0.014192 |
| Неделя 3 | 8.00 – 2.17 | 4.66 – 1.58 | 0.001851 |
| Неделя 4 | 7.00 – 2.59 | 2.88 – 1.45 | 0.000494 |
| ВАШ | |||
| Неделя 1 | 4.00 – 3.31 | 2.22 – 2.72 | 0.258083 |
| Неделя 2 | 3.33 – 2.69 | 2.00 – 2.44 | 0.436281 |
| Неделя 3 | 2.33 – 2.29 | 1.66 – 2.50 | 0.730440 |
| Неделя 4 | 2.33 – 2.29 | 0.77 – 1.71 | 0.222419 |
aU-критерий Манна — Уитни
ИМТ – индекс массы тела; Шкала PUSH - Pressure Ulcer Scale for Healing: СО – стандартное отклонение; ВАШ – Визуально-аналоговая шкала.
Рисунок 1. Изображения пациентов из контрольной и основной групп, которые подтверждают процедуру измерения начальной и конечной площадей (через 4 недели) язв на диабетической стопе.
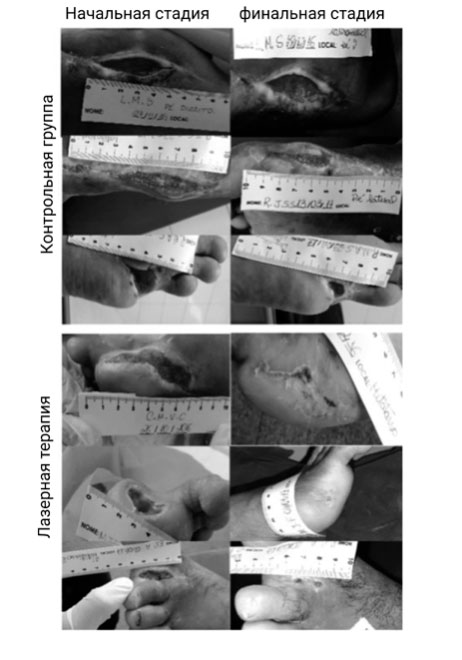
Рисунок 2. График индекса заживления ран в контрольной и основной группах, оцениваемый путем измерения начальной и конечной площади.
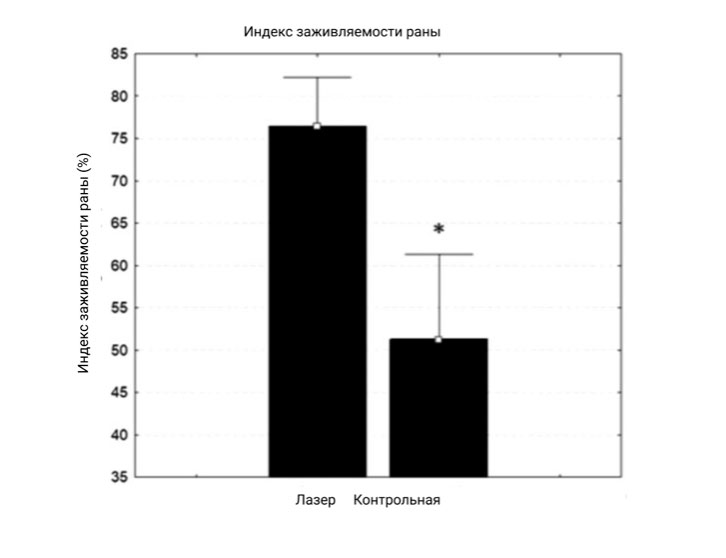
U-критерий Манна — Уитни, p ≤ 0.05.
Рисунок 3. На графике представлено еженедельное измерение ран по шкале PUSH. Внутригрупповое сравнение пациентов из контрольной группе с основной группой.
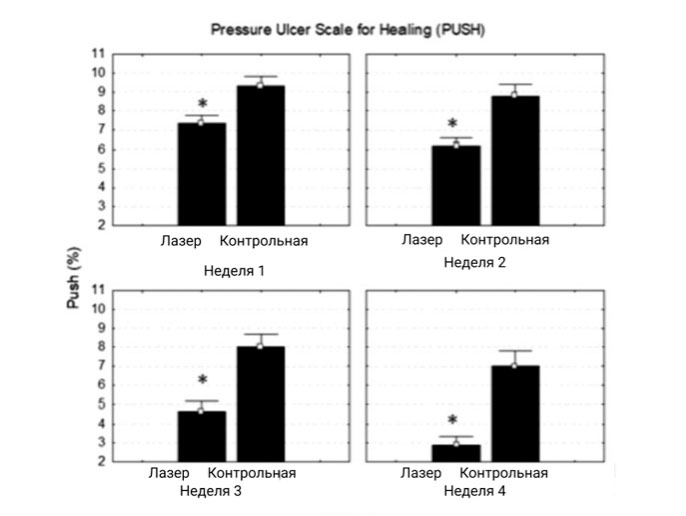
U-критерий Манна — Уитни, p ≤ 0.05.
Шкала PUSH - Pressure Ulcer Scale for Healing, *p = 0.01359.
Рисунок 4. Внутригрупповой график сравнения пациентов в контрольной группе с основной группой в отношении показателя боли по шкале ВАШ.
ВАШ – Визуально-аналоговая шкала.
Обсуждение
Исследование, проведенное в сети государственных больниц в Порту-Алегри с участием 467 пациентов, подтвердило, что 95.7% случаев ампутации произошли из-за клинических проблем со здоровьем, 50% из которых были связаны с СД [17]. Исследование, проведенное с использованием лазера на основе фосфида алюминия, галлия и индия (InGaAIP; 660 нм, 3 и 6 Дж/см2), в процессе заживления ран у крыс выявило увеличение количества кровеносных сосудов на 5-й день после облучения и сокращение краев кожи после 10-го дня лечения. Авторы считают, что неоваскуляризация напрямую связана с действием НИЛТ на кожные раны и что в этот же период они могли заметить уменьшение воспалительного процесса и выработку факторов роста [18].
Другие исследования показали, что НИЛТ активизирует митохондриальное дыхание и увеличивает уровни аденозинтрифосфата (АТФ) в клетках изолированных культур. Лазерный стимул проводит обмен кальция через клеточную мембрану, вызывая временные изменения уровня цитоплазматического кальция и способствует синтезу регулирующих белков. Эти изменения способствуют стимуляции клеточной пролиферации, необходимой для восстановления соединительной ткани в процессе заживления ран [19].
Начиная с шестого сеанса пациенты сообщали о возвращении периферической чувствительности и болевых ощущений, которые терялись годами из-за диабетической нейропатии. Во время еженедельного применения ВАШ не было различий в отношении боли между основной и контрольными группами, что связано с диабетической нейропатией. Диабетическая нейропатия является своего рода систематическим повреждением периферической нервной системы из-за хронической гипергликемии и других физиопатологических изменений, вызванных СД [20]. При сравнении пациентов из основной и контрольной групп, в данном исследовании в течение всех недель наблюдалась значительная разница в уровнях шкалы PUSH. Эта шкала является быстрым и надежным инструментом для мониторинга заживления ран [21].
Выводы
Использование НИЛТ доказало свою эффективность в отношении сокращения времени, которое необходимо для лечения язв при диабетической стопе. Кроме того, НИЛТ позволила вернуть болевую и тактильную чувствительность ног у некоторых пациентов, ранее страдавших полной анестезией нижних конечностей. Использование шкалы PUSH оказалось нужным и эффективным для мониторинга ран, так как с ее помощью оценивают их площадь, уровень экссудата и тип поражения ткани. Из-за диабетической нейропатии Визуально-аналоговая шкала боли была неэффективной.
Список литературы:
- 1. Iser BPM, Stopa SR, Chueiri PS, et al. Prevalence of selfreported diabetes in Brazil: results from the National Health Survey 2013. Epidemiol Serv Sau´de 2015;24:305–314.
- 2. World Health Organization. World Report on the Diabetes Overview of Orientation.
- 3. Santo PFE, Almeida AS, Silveira MM, Salome´ GM, Ferreira, LM. Use of the Pressure Ulcer Scale for Healing tool to evaluate the healing of chronic leg ulcers. Rev Bras CirPla´st 2013;28:133–141.
- 4. American Diabetes Association. Standards of Medical Care in Diabetes—2017. 2017;40(Suppl 1):S6–S10.
- 5. Martin VT, Rodrigues CDS, Cesariano CB. Knowledge of the patient with diabetes mellitus on foot care. Rev Enferm UERJ 2011;19:621–625.
- 6. Amin N, Doupis J. Diabetic foot disease: from the evaluation of the ‘‘foot at risk’’ to the novel diabetic ulcer treatment modalities. World J Diabetes 2016;7:153–164.
- 7. Zheng Y, Ji S, Wu H, et al. Acceleration of diabetic wound healing by acryopreserved living dermal substitute created by micronized amnion seeded with fibroblasts. Am J Transl Res 2015;7:2683–2693.
- 8. Lazo-Porras M, Bernabe-Ortiz A, Sacksteder KA, et al. Implementation of foot thermometry plus mHealth to prevent diabetic foot ulcers: study protocol for a randomized controlled trial. Trials 2016;17:206.
- 9. Silva PL, Rezende MP, Ferreira LA, Dias FA, Helmo FR, Silveira FCO. Foot care: the knowledge of individuals with diabetes mellitus enrolled in the family health program. Quarterly Electronic Nursing Journal 2015;37:52–64.
- 10. Gagnon D, Gibson WGT, Singh A, Linden ARZ, Kazienko JE, LaMarre J. An in vitro method to test the safety and efficacy of low-level laser therapy (LLLT) in the healing of a canine skin model. BMC Vet Res 2016; 12:73.
- 11. Carvalho Pde T, Silva IS, Reis FA, Perreira DM, Aydos RD. Influence of ingaalp laser (660 nm) on the healing of skin wounds in diabetic rats. Acta Cir Bras 2010;25:71.
- 12. Lins RDAU, Dantas EM, Lucena KCR, Granville-Garcia AF, Silva JSP. Application of low-power laser in wound healing. Odontol Clı´n Cient Recife 2011;(Suppl):511–516.
- 13. Vale AF, Moreira ME, Almeida FCS, Ramalho KM. Lowlevel laser therapy in the treatment of recurrent aphthous ulcers: a systematic review. ScientificWorldJournal 2015; 2015:150412.
- 14. Smaniotto PHS, Ferreira MCF, Isaac C, Galli R. Sistematizac¸a˜o de curativos para o tratamento clı´nico das feridas. Rev Bras Cir Pla´st 2012;27:623–626.
- 15. Santos VLCG, Azevedo MAJ, Silva TS, Carvalho VMJ, Carvalho VF. Adaptac¸a˜o transcultural do Pressure Ulcer Scale for Healing (PUSH) para a lı´ngua portuguesa. Rev Latino-Am Enf 2005;13:305–313. DOI: 10.1590/S0104-11692005000300004.
- 16. Martinez JE, Grassi DC, Marques LG. Analysis of the applicability of different pain questionnaires in three hospital settings: outpatient clinic, ward and emergency unit. Rev Bras Reumatol 2011;51:299–308.
- 17. Montiel A, Vargas M, Leal SMC. Characterization of persons undergoing amputation. Enfermagem Foco 2012;3: 169–173.
- 18. Tacon KCB, Santos HCO, Parente LML, et al. Healing activity of laser InGaAlP (660 nm) in rats. Acta Cir. Bras 2011;26:373–378. DOI: 10.1590/S010 2-86502011000500008.
- 19. Martins F, Renno´ ACM, Oliveira F, et al. Low-level laser therapy modulates musculoskeletal loss in a skin burn model in rats. Acta Ciru´rgica Brasileira 2015;30:94–99. DOI: 10.1590/S0102-86502015002000002.
- 20. Chenglong L, Jia T, Hui W, et al. Effects of LncRNA BC168687 siRNA on diabetic neuropathic pain mediated by P2X7 receptor on SGCs in DRG of RATS. BioMed Res Int 2017;2017:1–10.
- 21. Wei L, Yubo M, Qi Y, Yu P, Qinggang M. Moist exposed burn ointment for treating pressure ulcers: a multicenter randomized controlled trial. Medicine (Baltimore) 2017;96: e7582.